معتبر سازی GMP
در صنایع داروسازی، معتبرسازی (Validation) یعنی ایجاد مدارک مستند و مستدل به طوری که ثابت کند یک فرایند، دستورالعمل یا فعالیت، بهطور ثابت و مداوم محصولی با درجه بالائی از تضمین مطابق با خصوصیات کیفی از پیش تعیین شده تولید میکند.
در صنعت داروسازی، علاوه بر بررسی و تست نهایی محصولات، بسیار مهم است که مطمئن شویم یک فرایند بهطور مستمر و دایم نتایج مورد نظر را تولید میکند نتایج خروجی مطلوب به صورت مشخصات یا specificationها مقرر میشوند. از این رو ارزیابی یا Qualification سیستمها یا تجهیزات جزوی از فرایند معتبرسازی است. معتبرسازی برای صنایع و شرکتهای غذایی، دارویی و آژانسهای قانونگذاری دارویی مانند US FDA وGMP guidelines از الزامات می باشد.

فهرست خدمات معتبرسازی
برنامه جامع معتبر سازی
برنامه جامع معتبر سازی(validation master plan) که در برخی منابع به آن “طرح جامع معتبرسازی و معتبرسازی” نیز می گویند، اصول مربوط به احراز صلاحیت تجهیزات را مشخص میکند و مناطق و سیستمهایی را که باید معتبرسازی شوند را تعریف میکند. برنامه جامع معتبر سازی یک برنامه مکتوب برای دستیابی و حفظ تجهیزات واجد شرایط ارائه میکند. برنامه های معتبرسازی برای کمک به سازمان جهت تدوین استراتژیهای معتبرسازی یا ارائه کنترل بر یک فرآیند خاص نوشته میشوند.

معتبر سازی فرآیند
معتبر سازی فرآیند برای بهبود کیفیت محصولات انجام نمی شود، بلکه برای شناسایی موارد عدم انطباق در مراحل بحرانی فرآیند و انجام اقدامات اصلاحی مناسب برای کسب اطمینان لازم از کیفیت محصول انجام می شود. به عبارت دیگر، نتایج اعتبارسنجی فرآیند به نیاز به بهبود در فرآیندهای تولید اشاره دارد.
معتبر سازی فرآیند به عنوان شواهد مستندی تعریف میشود که نشان میدهد فرآیندی که بر اساس پارامترهای تعیینشده عمل میکند، میتواند به طور مؤثر و قابل تکرار برای تولید یک محصول دارویی مطابق با مشخصات از پیش تعیینشده و ویژگیهای کیفی آن عمل کند.
معتبر سازی فرآیند برای فرآیندهای جدید و زمانی که تغییرات بر اساس نتایج کنترل تغییرات و بررسی کیفیت، با در نظر گرفتن ارزیابی ریسک انجام شده باشد، انجام می شود.
معتبر سازی فرآیند
- معتبر سازی فرآیند (معتبر سازی فرآیند تولید) محصولات دارویی، بیوداروها، مکمل های غذایی و دستگاه های پزشکی
- معتبر سازی فرآیند برای لباس اتاق تمیز، تعریف پارامترهای بهینه: بازرسی / شستشو / خشک کردن / انبار کردن / استریل کردن / تامین.
- معتبر سازی فرآیند برای انتقال نمونه ها به اتاق های تمیز و determination of decontamination time of pass boxes.
نکات کلیدی
- معتبر سازی فرآیند می تواند آینده نگر (برای تاسیسات پشتیبان، قبل از راه اندازی) و همزمان با فرایند تولید معمول باشد.
- بر اساس آخرین نسخه از مقررات GMP، اعتبار سنجی گذشته نگر دیگر یک رویکرد قابل قبول در نظر گرفته نمی شود.
- معتبر سازی فرآیند در داروسازی ها ارتباط نزدیک و مبتنی بر قوانین GMP دارد و مرحله نهایی معتبر سازی است که پس از تکمیل تمام مراحل احراز کیفیت/ کیفیت انجام می شود.
- جهت انجام فرایند معتبر سازی، در ابتدا تجزیه و تحلیل کاملی برای شناسایی فرآیندهای حیاتی انجام می شود و هرگونه خطا و اشتباهی می تواند بر کیفیت محصولات تولیدی و پارامترهای حیاتی یک فرآیند خاص تأثیر بگذارد.
به عنوان مثال، پارامترهای مهم برای ساخت قرصهای روکشدار، تهیه مواد گرانول، قرصسازی و روکش است. پارامترهای مهمی که بر کیفیت این فرآیندها تاثیر دارند، پارامترهای دانهبندی (دما، زمان، نرخ پاشش سیال گرانول سازی و غیره)، پارامترهای عملیاتی پرس (نیروی فشار و ظرفیت) و پارامترهای حیاتی روکش (سرعت پن، دما، تعداد دور، فشار اتمایز و پاشش مواد روکش) میباشد.
- نتایج معتبر سازی فرآیند باید در گزارشی ارائه شود و در آن نتایج ارزیابی صحت پارامترهای فرآیند ، ارزیابی دقت و کفایت روشهای فرآیند، ارزیابی ظرفیت تجهیزات برای اطمینان از توانایی آن در برآوردن پارامترهای فرآیند، ارزیابی تکرارپذیری پارامترهای فرآیند و در نتیجه اطمینان از کیفیت مورد نیاز، ارائه شود.

معتبر سازی پروسه تمیز کردن
معتبر سازی پروسه تمیز کردن برای بهبود کیفیت محصولات انجام نمی شود، بلکه نتایج معتبر سازی پروسه تمیز کردن منجر به بهبود در فرآیندهای تولید اشاره دارد.
معتبر سازی پروسه تمیز کردن تجهیزات برای فرآیندهای جدید، در فواصل دورهای، بر اساس نتایج کنترل تغییرات و بررسیهای کیفیت، با در نظر گرفتن ارزیابی ریسک انجام شده است، انجام میشود.
معتبر سازی پروسه تمیز کردن شواهد مستندی است مبنی بر اینکه یک روش تمیز کردن تایید شده، تجهیزات تمیز و مناسبی را برای تولید ایمن محصولات دارویی فراهم می کند.
نکات کلیدی
معتبر سازی پروسه تمیز کردن شامل محاسبه حداکثر باقیمانده مواد فعال و مواد شوینده تمیزکننده است که ممکن است در تجهیزات تمیز شده وجود داشته باشد اما تأثیر قابل توجهی بر کیفیت دسته بعدی یا محصول جدید تولید شده روی این تجهیزات ندارد. برنامه و روش نمونه گیری برای تعریف کارایی بازیابی روش نمونه گیری توسعه یافته است. غلظت آلاینده تعریف شده با روش تحلیلی با در نظر گرفتن مساحت و مواد سطح تجهیزات که در تماس مستقیم با محصول است محاسبه می شود.
معتبر سازی پروسه تمیز کردن تجهیزات، اثربخشی روش تمیز کردن را برای جلوگیری از آلودگی محصول بعدی توسط محصول قبلی، عوامل تمیزکننده یا آلایندههای میکروبی و تکرارپذیری روش تمیز کردن انتخاب شده تأیید میکند.

معتبر سازی اتاق سرد
بسیاری از مقررات بین المللی (GMP، GDP و GSP) وجود دارد که بیان می کند شرایط نگهداری محصولات دارویی باید به طور مداوم حفظ شود. هدف از معتبر سازی محفظه سرد این است که اطمینان حاصل شود که شرایط نگهداری محصولات و مواد دارویی با اطلاعات ذکر شده روی برچسب مطابقت دارد.
فرآیند معتبر سازی اتاق سرد ارائه شواهد مستندی است مبنی بر اینکه شرایط نگهداری محصولات در تمام قسمت های یک اتاق سرد، در هر قفسه و در مکان هایی که محصولات در آنجا نگهداری می شوند، یکسان بوده و به صورت پیوسته حفظ می شود.
خدمات قابل ارایه
- معتبر سازی اتاق های سرد
- معتبر سازی فریزرها
- معتبر سازی یخچال ها

معتبرسازی سیستم های کامپیوتری
معتبرسازی سیستم های کامپیوتری کل چرخه عمر یک سیستم کامپیوتری را از زمان طراحی تا پایان را پوشش می دهد. معتبرسازی سیستم های کامپیوتری، فرآیند دستیابی و حفظ انطباق با مقررات GxP قابل اجرا و متناسب جهت:
پذیرش اصول، رویکردها و فعالیتهای چرخه فرایند در چارچوب برنامهها و گزارشهای معتبرسازی.
بکارگیری کنترل های عملیاتی مناسب در طول عمر سیستم.
GAMP 5 به عنوان راهنمایی برای ایجاد سیستم و معتبرسازی سیستم های کامپیوتری عمل می کند. GAMP دستورالعمل هایی هستند که استراتژی را تعریف می کنند و توصیه های کلی را ارائه می دهند. معتبرسازی سیستم های کامپیوتری نیز بر اساس EU GMP Annex 11انجام می شود:
Computerized Systems and 21CFR Part 11 FDA USA Electronic Records; Electronic Signatures
بر اساس GAMP، سیستم های کامپیوتری به 5 دسته تقسیم می شوند:
– سیستم های عامل
– برنامه نرم افزاری روی دستگاه سخت افزاری
– نرم افزار استاندارد
– نرم افزار پیکربندی شده
– نرم افزار سفارشی
اسناد معتبر سازی سیستم کامپیوتری:
مشخصات مورد نیاز کاربر (URS) مشخصاتی برای توسعه سیستم های کامپیوتری
– طراحی
– مشخصات عملکردی (FS)
– مشخصات فنی (TS)
– مشخصات پیکربندی (CS)
– دستورالعمل های کاربری و نگهداری

احراز کیفیت
احراز کیفیت شواهد مستندی است که نشان میدهد یک تجهیزات و یا سیستم خاص به درستی عمل میکند، تکرارپذیر است و منجر به نتایج مورد انتظار میشود. احراز کیفیت از نظر دامنه کوچکتر از معتبر سازی است و تعریف جداگانه ای در رابطه با تست پارامترهای تاسیسات، فرآیند تولید، فرآیند و تجهیزات آزمایشگاهی و سایر امکانات برای اطمینان از انطباق آنها با استانداردهای GMP و سایر مقررات حاکم بر تولید ایمن دارو تعریف می کند.
احراز کیفیت تاسیسات، تجهیزات و آزمایشگاه ها
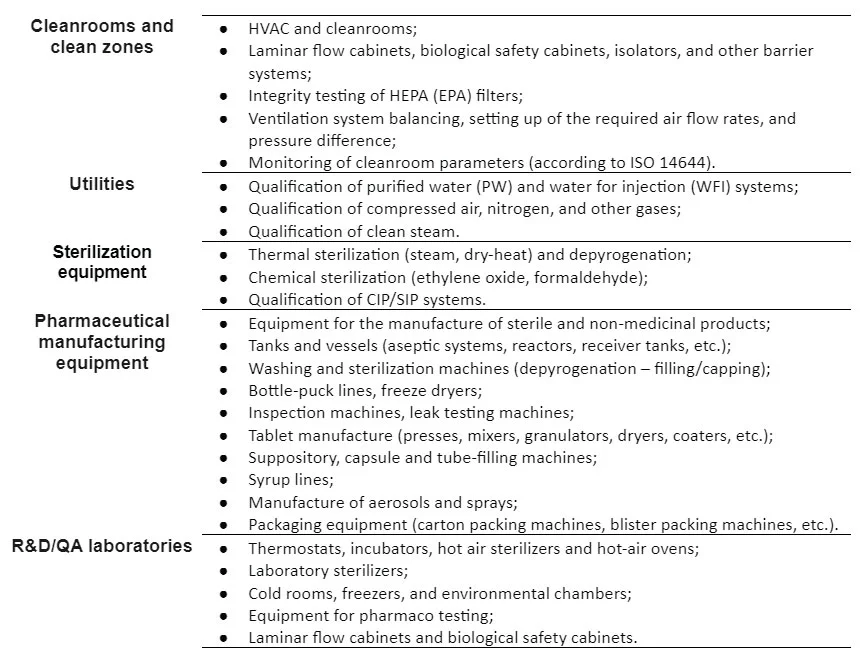
مراحل اصلی احراز کیفیت:
Design qualification (DQ)
یک تأیید مستند است که نشان میدهد طراحی پیشنهادی تأسیسات، سیستمها و تجهیزات (تجهیزات، انبار و غیره) با الزامات مشخصات مورد نیاز کاربر (URS) و GMP مطابقت دارد.
Installation Qualification (IQ)
یک تأیید مستند است که نشان میدهد امکانات، سیستمها یا تجهیزاتی که نصب یا اصلاح شدهاند، با طراحی تایید شده و سایر اسناد فنی مطابقت دارند.
Operational Qualification (OQ)
یک تأیید مستند است که نشان میدهد تأسیسات، سیستمها یا تجهیزات، همانطور که نصب یا اصلاح شدهاند، مطابق با هدف در محدوده عملیاتی پیشبینیشده عمل میکنند.
Performance Qualification (PQ)
یک تأیید مستند است که نشان می دهد تأسیسات، سیستم ها یا تجهیزات، همانطور که به یکدیگر متصل هستند، می توانند به طور مؤثر و قابل تکرار بر اساس روش فرآیند تأیید شده، دستورالعمل های اصلی تولید و مشخصات محصول انجام دهند.
همچنین بازدیدهایی را برای انجام FAT (تست پذیرش کارخانه) در سایت سازنده و SAT (تست پذیرش سایت) در سایت مشتری ترتیب می دهیم.
انواع خدمات مورد تقاضا در صنعت داروسازی:
- Qualification of syrup filling lines
- Qualification of aerosol and spray productions
- Qualification of packaging equipment
- Qualification of blister packing machines
- Qualification of carton packing machines
- Qualification of thermostats
- Qualification of incubators
- Qualification of environmental chambers
- Qualification of laboratory sterilizers
پروتکل احراز کیفیت:
پروتکل احراز کیفیت سندی است برای تشریح فعالیت هایی که برای تست و ارزیابی پارامترهای خاص ، معیارهای پذیرش هر یک از این پارامترها، معیارهای ارزیابی، روش های اندازه گیری و ابزار اندازه گیری، از جمله اطلاعات مربوط به دقت، تأیید و کالیبراسیون آنها ، انجام می شود.
پروتکل احراز کیفیت سندی است که در آن نتایج فعالیت های تکمیل شده احراز کیفیت ، اطلاعات اولیه در مورد موضوع احراز کیفیت ، تجزیه و تحلیل داده های به دست آمده، پیشنهادات برای انجام مجدد احراز کیفیت و نتیجه گیری جمع آوری می شود.

احراز کیفیت طراحی
اولین مرحله معتبر سازی تاسیسات، سیستم ها یا تجهیزات جدید می تواند احراز کیفیت طراحی (DQ) باشد. مطابقت طرح با الزامات GMP باید نشان داده و مستند شود.
احراز کیفیت طراحی (DQ) سند معتبری است مبنی بر اینکه طراحی های انجام شده کارخانه(شامل فضاهای کاربری، تأسیسات پشتیبان، تجهیزات، انبار و غیره) با مشخصات مورد نیاز کاربر (URS) و GMP مطابقت دارد.
پارامتر های کلیدی احراز کیفیت طراحی شامل:
- تأیید تداوم فرآیند
- به حداقل رساندن خطر آلودگی
- سازمان دهی فلوی مواد و پرسنل
- اطمینان از صحت کلاس بندی اتاق تمیز
- اختلاف فشار بین اتاق ها
- ایجاد شرایط مناسب برای نظافت مؤثر فضاها، تجهیزات و تأسیسات
- گروه بندی بهینه و موثر فضاها، تجهیزات و تأسیسات با کلاس مشابه
- قرار دادن کارآمد تجهیزات و مواد برای جلوگیری از mix-up بین اجزای مختلف
خدمات ما در زمینه احراز کیفیت طراحی
- احراز کیفیت طراحی خطوط تولید دارویی
- احراز کیفیت طراحی اتاق تمیز بیمارستانی (
- سلول درمانی و شیمی درمانی و …)
- احراز کیفیت طراحی خطوط تولید محصولات دامی
- احراز کیفیت طراحی آزمایشگاه های کنترل کیفیت
- احراز کیفیت طراحی انبارها
- احراز کیفیت طراحی تاسیسات (آب، هوای فشرده، بخار)
- احراز کیفیت طراحی سیستم های تهویه مطبوع برای اتاق های تمیز

احراز کیفیت اتاق تمیز
اتاق تمیز یک راه حل مهندسی برای تامین یک اتاق خاص است که به شما امکان می دهد غلظت آلاینده ها را در محدوده مشخصی با توجه به استانداردهای تعیین شده برای تولید محصولات مختلف حفظ کنید. احراز کیفیت اتاق های تمیز برای تأیید اینکه اتاق تمیز مطابق با استانداردها و الزامات مربوطه کار می کند انجام می شود. احراز کیفیت اتاق تمیز شواهد مستندی است که نشان می دهد یک اتاق تمیز با سطح مشخصی از تمیزی مطابقت دارد.
فعالیت های قابل انجام در فرایند احراز کیفیت اتاق تمیز
- احراز کیفیت اجرای اتاق تمیز و نصب سیستم HVAC
- احراز کیفیت سیستم HVAC
- تست فیلترهای НЕРА
- تنظیم و بالانسینگ سیستم های تهویه مطبوع
- مانیتورینگ اتاق های تمیز
- احراز کیفیت Laminar Air Flow
- احراز کیفیت انوع هود ها
- احراز کیفیت biological safety cabinets
- صدور گواهینامه نهایی اتاق های تمیز
ما تمامی مراحل احراز کیفیت اتاق های تمیز ، Laminar Air Flow ، biological safety cabinets ، فضای نمونه برداری و غیره راانجام می دهیم:
- DQ (Design qualification);
- IQ (Installation qualification);
- OQ (Operation qualification);
- PQ (Performance qualification).

احراز کیفیت سیستم های آب خالص ساز
آب مورد استفاده در صنعت داروسازی (جهت تولید داروها، شستشو و تمیز کردن سطوح و تجهیزات) به طور مستقیم بر کیفیت محصولات تأثیر می گذارد. احراز کیفیت سیستم های آب خالص ساز PW و WFI باید به طور کامل انجام شود (DQ، IQ، OQ، PQ). علاوه بر این، سیستمهای PW و WFI به طور مداوم و پیوسته کار میکنند، که نیاز به نظارت منظم بر عملکرد آنها وپارامترهای حیاتی و احراز کیفیت دورهای دارد.
احراز کیفیت سیستم های آب خالص ساز شواهد مستندی است که نشان می دهد سیستم آب خالص ساز با استانداردهای GMP و سایر مقررات مطابقت دارد. در فرایند احراز کیفیت باید نشان داد که سیستم آب خالص ساز به درستی عمل می کند و به طور مداوم آب با کیفیت مطلوب تولید می کند.
مراحل احراز کیفیت سیستم های آب خالص ساز
- DQ – Design qualification;
- IQ – Installation qualification;
- OQ – Operation qualification;
- PQ – Performance qualification;
- Justification for monitoring system;
- Selection of frequency and methods of preventive maintenance and sanitation.
احراز کیفیت سیستم های آب خالص ساز بر اساس استاندارد های زیر انجام می شود:
- FDA Guide to Inspections of High Purity Water Systems;
- ISPE Baseline Pharmaceutical Engineering Guide, Volume 4: Water and Steam Guide;
- PI 009-3 “Ide-Memoire inspection of utilities”;
- PDA Technical Report No. 4 Design Concepts for the Water for Injection System;
- WHO Good Manufacturing Practices, Annex 3: water for pharmaceutical use.

احراز کیفیت بخار خالص
احراز کیفیت بخار خالص مورد استفاده در صنایع دارویی (در استریل کننده ها برای استریل کردن قطعات، ابزارها و مجموعه ها، در سیستم های SIP) بخش اساسی سیستم تضمین کیفیت محصولات است.
ممکن است تست بخار تمیز را برون سپاری کنید و یا خودتان این روش را انجام دهید، اما برای انجام این کار به یک کیت تست نیاز است.
احراز کیفیت سیستم بخار خالص شواهد مستندی است که نشان می دهد:
- سطح گازهای غیر قابل تراکم موجود در بخار مانع از دستیابی به شرایط استریلیزاسیون در هیچ بخشی از بار استریل کننده نخواهد شد.
- رطوبت اضافی باعث ایجاد بارهای مرطوب نمی شود.
- کیفیت بخار خالص (اندتوکسین های باکتریایی، TOC و هدایت الکتریکی) در محدوده قابل قبول می باشد.
مراحل اصلی و مدت

مراحل احراز کیفیت سیستم بخار خالص
- DQ – Design qualification;
- IQ – Installation qualification;
- OQ – Operation qualification;
- PQ – Performance qualification.
احراز کیفیت سیستم بخار خالص بر اساس استاندارد های زیر انجام می شود:
- DIN 58950 Sterilization – Steam sterilizers for pharmaceutical products Part 7: Requirements on services and installation;
- DIN EN 13824 Sterilization of medical devices – Aseptic processing of liquid medical devices – Requirements;
- ISPE Baseline Pharmaceutical Engineering Guide, Volume 4: Water and Steam Guide;
- DIN EN 285 Sterilization – Steam Sterilizers – Large Sterilizers;
- HTM 2010 Sterilization
احراز کیفیت هوای فشرده
هوای فشرده یکی از پرکاربردترین منابع انرژی و به طور گسترده در صنعت داروسازی استفاده می شود. در صنعت داروسازی، هوای فشرده بدون تصفیه مناسب ممکن است بر تجهیزات تأثیر بگذارد و منجر به کاهش کیفیت محصول شود. به همین دلیل است که احراز کیفیت هوای فشرده یک فرآیند ضروری است.
احراز کیفیت هوای فشرده شواهد مستندی است که نشان میدهد پارامترهایی مانند تعداد پارتیکل، نقطه شبنم، concentration of liquid water ، میزان بخار، میزان ذرات روغن و سایر آلایندهها در محدوده قابل قبول هستند و باعث آلودگی محصول نمیشوند.
Dräger Aerotest، یک ابزار کاربردی است که برای احراز کیفیت هوای فشرده استفاده می شود.
کلاس های خلوص هوای فشرده
مراحل احراز کیفیت سیستم هوای فشرده
- DQ – Design qualification;
- IQ – Installation qualification;
- OQ – Operation qualification;
- PQ – Performance qualification.
احراز کیفیت تجهیزات
شرکت ما طیف کاملی از خدمات را ارائه می دهد: تهیه مشخصات مورد نیاز کاربر (URS) برای تجهیزاتی که باید خریداری شود، احراز کیفیت تجهیزات، انجام مراحل PQ/PV (احراز کیفیت عملکرد / معتبر سازی فرآیند).
احراز کیفیت تجهیزات شواهد مستندی است که نشان می دهد تجهیزات با الزامات GMP مطابقت دارند، در محدوده عملیاتی مشخص شده کار می کنند و برای تولید محصولات با کیفیت مورد نیاز مناسب هستند.
احراز کیفیت تجهیزات شامل فعالیت های زیر است:
- ارزیابی مشخصات مورد نیاز کاربر (URS) برای تجهیزات خریداری شده ، بررسی اینکه ویژگیها و ظرفیت تجهیزات با الزامات فرآیند تولید مطابقت دارند.
- پشتیبانی و نظارت بر فرآیندهای تولید و تامین تجهیزات؛
- بررسی و تأیید اسناد و مدارک سازنده؛
- بررسی ظاهر و برچسب گذاری تجهیزات؛
- تأیید اینکه مشخصات تجهیزات مطابق با مشخصات درج شده در مدارک و مستندات تجهیز می باشد، بررسی اینکه تجهیزات به درستی و مطابق نقشه های آن نصب شده است.
- اطمینان از مطابقت با الزامات GMP؛
- به دست آوردن شواهد مستند مبنی بر عملکرد صحیح تجهیزات و عملکرد موثر سیستم های اضطراری، اینترلاک و هشدارها.
- نظارت بر کارایی سیستم های کنترل؛
- اطمینان از صحت عملکرد دستگاه های اندازه گیری (نظارت بر کالیبراسیون ابزارهای اندازه گیری موثر بر کیفیت محصول و ایمنی).
- پایش قابلیت اطمینان و تکرارپذیری پارامترهای مهم، از جمله Worst-Case Scenario.
مراحل احراز کیفیت تجهیزات
- DQ – Design qualification;
- IQ – Installation qualification;
- OQ – Operation qualification;
- PQ – Performance qualification.
خدمات ماناک فارمد در معتبر سازی تجهیزات:
معتبر سازی تجهیزات خطوط تولید داروهای استریل:
- Aseptic systems;
- Reactors, tanks and other vessels;
- Fermenters, equipment used in biopharmaceutical manufacturing;
- Sterile filtration systems;
- Washing lines – sterilization/depyrogenation – filling – capping;
- Freeze dryers;
- Steam/irrigation sterilizers for the sterilization of finished products and materials;
- Equipment used in manufacturing prefilled syringes;
- Bottle-puck lines;
- Inspection machines;
- Leak testing machines.
معتبر سازی تجهیزات خطوط تولید داروهای غیر استریل:
- Tablet Manufacture (presses, mixers, granulators, dryers, coaters, etc.);
- Suppository, capsule and tube-filling machines;
- Equipment used in the manufacture of aerosols and sprays;
- Syrup lines;
- Powder filling machines.
معتبر سازی تجهیزات خطوط بسته بندی داروها:
- Carton packing machines;
- Blister packing machines;
- Labeling machines.
معتبر سازی تجهیزات آزمایشگاه های کنترل و تضمین کیفیت، تحقیق و توسعه:
- Thermostats, incubators, hot air sterilizers and hot-air ovens;
- Laboratory sterilizers;
- Cold chambers, freezers and environmental chambers;
- Equipment for pharmacotesting;
- Isolators, laminar flow cabinets and biological safety cabinets.
احراز کیفیت سیستم های CIP
سیستم CIP یا Clean-in-place. سیستم CIP امکان تمیز کردن قابل تکرار را می دهد و خطر آلودگی متقابل را کاهش می دهد. احراز کیفیت سیستم های CIP عملکرد مناسب تجهیزات را نشان می دهد.
احراز کیفیت سیستم های CIP شواهد مستندی است که نشان می دهد یک چرخه تمیز کردن استاندارد سطح تمیزی تجهیزات را برای تولید ایمن محصولات بعدی فراهم می کند.
با استفاده از بال اسپری ها (ایستا، چرخان و متحرک عمودی) تمیز کاری تمام سطوح داخلی تجهیزات (از جمله مناطقی که دسترسی به آنها سخت است) تضمین میشود.
طی فرایند معتبر سازی، مناطقی که تمیز کردن آنها سخت است، با استفاده از یک نشانگر خاص باید مشخص شود. راندمان عملکرد بال اسپری ها به صورت بصری در زیر نور مرئی و UV تعریف می شود. پارامترهای حیاتی فرآیند تمیز کردن دمای سیال ، فشار سیال (سرعت جریان) و زمان تمیز کردن و همچنین غلظت مواد شوینده و تعداد چرخههای تمیز کردن است.
در صنعت داروسازی و بیوتکنولوژی، فرآیندهای CIP مقدم بر فرآیندهای استریلیزاسیون هستند.
مراحل احراز کیفیت سیستم CIP
- DQ – Design qualification;
- IQ – Installation qualification;
- OQ – Operation qualification;
- PQ – Performance qualification.

احراز کیفیت انبارها
بر اساس بسیاری از مقررات بین المللی (GMP، GDP و GSP)، احراز کیفیت انبار ها (انبار دارویی، انبار داروخانه و انبار توزیع) باید انجام شود. هدف از احراز کیفیت انبار این است که اطمینان حاصل شود که شرایط نگهداری محصولات و مواد دارویی با برچسب مطابقت دارد و شرایط دمای هوا و رطوبت نسبی کنترل می گردد.
احراز کیفیت انبار، شواهد مستندی است مبنی بر اینکه شرایط نگهداری محصولات در کل فضای انبار، روی هر قفسه و مکانهایی که محصولات در آن نگهداری میشوند، حفظ میشود.
سیستم گرمایش و تهویه مطبوع در انبار دارو باید دمای محیط و در صورت لزوم رطوبت هوا را در هر ساعت از روز و هر روز از هفته در تمام فصول سال در دمای تعریف شده حفظ کند. بنابراین، احراز کیفیت انبار باید این شرایط را در بر گیرد و حداقل برای دو فصل بحرانی آب و هوایی، زمانی که دمای محیط بالاتر یا کمتر از دمای نگهداری محصول در یک انبار است، انجام شود که با عملکرد سیستم های خنک کننده در انبار. فصل گرم سال و سیستم های گرمایشی در فصل سرد سال صورت می پذیرد. در صورت لزوم، احراز کیفیت حمل و نقل ممکن است انجام شود.
برای دریافت مشاوره رایگان در مورد اتاق تمیز و معتبرسازی GMP، با ما در تماس باشید
تجربه متفاوت و خدمات تخصصی را با ماناک تجربه کنید

